Elektromagnetische Wellen: Unterschied zwischen den Versionen
| [unmarkierte Version] | [unmarkierte Version] |
K |
K |
||
| (3 dazwischenliegende Versionen von einem anderen Benutzer werden nicht angezeigt) | |||
| Zeile 37: | Zeile 37: | ||
:''h'' = Plancksche Wirkungskonstante | :''h'' = Plancksche Wirkungskonstante | ||
===elektromagnetisches Wellenspektrum=== | ===elektromagnetisches Wellenspektrum=== | ||
| − | {|border="1" cellspacing="0" cellpadding="5" style="border-collapse:collapse;" width=" | + | {|border="1" cellspacing="0" cellpadding="5" style="border-collapse:collapse;" width="80%" |
!width="40%"|Wellenlänge | !width="40%"|Wellenlänge | ||
!width="60%"|Wellenart | !width="60%"|Wellenart | ||
| Zeile 83: | Zeile 83: | ||
|10<sup>-14</sup> m = 10 fm || kosmische Strahlen | |10<sup>-14</sup> m = 10 fm || kosmische Strahlen | ||
|} | |} | ||
| − | [[Bild:Thema Licht 2.jpg]] | + | [[Bild:Thema Licht 2.jpg|150px|thumb|right|Spektrum des sichtbaren Lichtes in einem Prisma]] |
Das Spektrum der elektromagnetischen Welle zeigt uns, daß Licht nichts weiter als einen für uns sichtbaren Teil aus diesem Spektrum darstellt. Licht ist also einen elektromagnetische welle, wobei sich die Energie dieser welle als Phontonen, kleiner Energiequanten, fortpflanzt. Licht ist also die Aussendung einzelner Strahlungsbündel/Phontonen, deren Weg durch den Lichtstrahl begrenzt und gekennzeichnet wird. Die Ausbreitungsrichtung ist zumindest für den Bereich der geometrischen Optik als geradlinig anzusehen. <br> | Das Spektrum der elektromagnetischen Welle zeigt uns, daß Licht nichts weiter als einen für uns sichtbaren Teil aus diesem Spektrum darstellt. Licht ist also einen elektromagnetische welle, wobei sich die Energie dieser welle als Phontonen, kleiner Energiequanten, fortpflanzt. Licht ist also die Aussendung einzelner Strahlungsbündel/Phontonen, deren Weg durch den Lichtstrahl begrenzt und gekennzeichnet wird. Die Ausbreitungsrichtung ist zumindest für den Bereich der geometrischen Optik als geradlinig anzusehen. <br> | ||
In der Aussendung von Phontonen liegt ein Dilemma, der Wellen-Teilchen-Dualismus. Während die Teilchenbetrachtung der Photonen von einer Korpus Kularstrahlung ausgeht, wollen wir an der Wellentheorie festhalten. <br> | In der Aussendung von Phontonen liegt ein Dilemma, der Wellen-Teilchen-Dualismus. Während die Teilchenbetrachtung der Photonen von einer Korpus Kularstrahlung ausgeht, wollen wir an der Wellentheorie festhalten. <br> | ||
| Zeile 98: | Zeile 98: | ||
Je dichter das Medium wird, um so geringer wird die Geschwindigkeit.(Lichtgeschwindigkeit, gemessen im Jahre 1673 von dem dänischen Astronom Olaf Römer, 1644 bis 1710). Die Frequenz der Lichtschwingung ist sehr hoch und beträgt im Mittel 10 15 Hz. Das menschliche Auge erfasst Wellenlängen im Bereich zwischen 390 nm (violett) und 770 nm (rot). Dieser sichtbare Bereich umfaßt im Gegensatz zum Hörbereich mit 10 Oktaven nur etwa 1 Oktave (1 Oktave -> Verdoppelung der Frequenz). Jede Wellenlänge kennzeichnet eine bestimmte Farbe im Lichtspektrum. Man nennt Licht einer bestimmten Wellenlänge monochromatisch. <br> | Je dichter das Medium wird, um so geringer wird die Geschwindigkeit.(Lichtgeschwindigkeit, gemessen im Jahre 1673 von dem dänischen Astronom Olaf Römer, 1644 bis 1710). Die Frequenz der Lichtschwingung ist sehr hoch und beträgt im Mittel 10 15 Hz. Das menschliche Auge erfasst Wellenlängen im Bereich zwischen 390 nm (violett) und 770 nm (rot). Dieser sichtbare Bereich umfaßt im Gegensatz zum Hörbereich mit 10 Oktaven nur etwa 1 Oktave (1 Oktave -> Verdoppelung der Frequenz). Jede Wellenlänge kennzeichnet eine bestimmte Farbe im Lichtspektrum. Man nennt Licht einer bestimmten Wellenlänge monochromatisch. <br> | ||
An die Farbe rot (780 nm) grenzt der Infrarotbereich, eine unsichtbare Wärmestrahlung. An die Farbe violett (380 nm) grenzt die UV-Strahlung, die ja ihrer bräunenden Eigenschaften wegen sehr geschätzt wird. Die Mischung aller Farben im Farbspektrum ergibt den Farbeindruck weis (additive Farbmischung). <br> | An die Farbe rot (780 nm) grenzt der Infrarotbereich, eine unsichtbare Wärmestrahlung. An die Farbe violett (380 nm) grenzt die UV-Strahlung, die ja ihrer bräunenden Eigenschaften wegen sehr geschätzt wird. Die Mischung aller Farben im Farbspektrum ergibt den Farbeindruck weis (additive Farbmischung). <br> | ||
| − | Wird der gesamte Frequenzbereich absorbiert, also kann keine sichtbare Frequenz emittiert (abgestrahlt) werden, entsteht der Farbeindruck schwarz (Subtraktive Farbmischung). Schwarz und Weiß sind also keine Farben sondern stellen nur Mischprodukte aus dem sichtbaren Spektrum dar . Genaugenommen gibt es nur 6 Farben im Spektrum, die sogenannten Spektralfarben: <br> | + | Wird der gesamte Frequenzbereich absorbiert, also kann keine sichtbare Frequenz emittiert (abgestrahlt) werden, entsteht der Farbeindruck schwarz (Subtraktive Farbmischung). Schwarz und Weiß sind also keine Farben sondern stellen nur Mischprodukte aus dem sichtbaren Spektrum dar . Genaugenommen gibt es nur 6 Farben im Spektrum, die sogenannten '''Spektralfarben:''' <br> |
<center>'''<span style="color:red">Rot</span>, <span style="color:orange">Orange</span>, <span style="color:yellow">Gelb</span>, <span style="color:green">Grün</span>, <span style="color:blue">Blau</span>, <span style="color:purple">Violett</span></center><br> | <center>'''<span style="color:red">Rot</span>, <span style="color:orange">Orange</span>, <span style="color:yellow">Gelb</span>, <span style="color:green">Grün</span>, <span style="color:blue">Blau</span>, <span style="color:purple">Violett</span></center><br> | ||
Sie sind nicht weiter zerlegbar, der Übergang von Farbe zu Farbe ist allmählich und enthält viele Farbnuancen, so daß jede Spektralfarbe im Spektrum einen bestimmten Frequenzbereich einnimmt.<br> | Sie sind nicht weiter zerlegbar, der Übergang von Farbe zu Farbe ist allmählich und enthält viele Farbnuancen, so daß jede Spektralfarbe im Spektrum einen bestimmten Frequenzbereich einnimmt.<br> | ||
| − | |||
An dieser stelle ist es wichtig, den Zusammenhang von Farbe/Frequenz - zugeführter Energie - und Elementen herzustellen | An dieser stelle ist es wichtig, den Zusammenhang von Farbe/Frequenz - zugeführter Energie - und Elementen herzustellen | ||
Die Tatsache, das ein Element bei Energiezufuhr nicht nur eine bestimmte Frequenz ausstrahlt (emittiert) sondern genau diese Frequenz auch absorbiert, also in sich aufnimmt, öffnet den Bereich der Spektralanalyse. <br> | Die Tatsache, das ein Element bei Energiezufuhr nicht nur eine bestimmte Frequenz ausstrahlt (emittiert) sondern genau diese Frequenz auch absorbiert, also in sich aufnimmt, öffnet den Bereich der Spektralanalyse. <br> | ||
| Zeile 122: | Zeile 121: | ||
|temperaturabhängiges Nachleuchten || Phosphorreszenz | |temperaturabhängiges Nachleuchten || Phosphorreszenz | ||
|} | |} | ||
| − | -- Jonathan Michael Scott 13:01, 31. Dez 2005 (CET) | + | -- [[Benutzer:John Scott|Jonathan Michael Scott]] 13:01, 31. Dez 2005 (CET) |
==Links== | ==Links== | ||
{{Navigation:Thema Physik}} | {{Navigation:Thema Physik}} | ||
[[Kategorie:Wissenschaft]] | [[Kategorie:Wissenschaft]] | ||
Aktuelle Version vom 31. Dezember 2005, 12:31 Uhr
Inhaltsverzeichnis
Entstehung des Lichtes
Die Natur des Lichtes ist bis zum heutigen Tag noch nicht abschließend geklärt, so muss man sich, um sein verhalten zu verstehen, mit verschiedenen Denkmodellen behelfen.
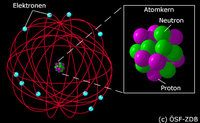
Ein kleiner Ausflug in die Atomphysik
So ein Denkmodell ist auch das Atommodell von Bohr - Rutherford. Es geht davon aus, dass sich um ein Atomkern, der im wesentlichen aus positiven geladenen Protonen und neutralen Neutronen besteht, negativ geladene Elektronen aufhalten (Teilchenbetrachtung).
Die Elektronen umkreisen bzw. umhüllen diesen Atomkern auf sphärischen Schalen, welche festgelegt Radien zum Atomkern also einen festen Abstand besitzen.
Die Schalen und ihr Radius zum Kern, entsprechen einem energetischen Gleichgewichtszustand, den so genannten Quantenbahnen. Dieser verhindert, dass sich das Elektron weder zum Kern hin stürzt, noch vom Kern weg flieht. Das Gleichgewicht entsteht zwischen dem elektrostatischen Feld Elektron-Proton (Zentripetalkraft) und der Winkelbeschleunigung (Initialbeschleunigung) des Elektrons.
Außerdem emittiert das Elektron auf seiner jeweiligen Schale keine Strahlung. Dieser Umstand ist bemerkenswert, da ein Teilchen, das sich durch ein elektrostatisches Feld bewegt, eigentlich ein magnetisches Feld hervorrufen .
Die Anzahl der Teilchen in Kern bestimmen u.a. das Gewicht, die Anzahl der Teilchen auf der schale bestimmen im wesentlichen die Eigenschaften der Materie und lasen sich in den Elementen klassifizieren, welche in Periodensystem der Elemente geordnet sind. Im weiteren wollen wir nur die Elektronen betrachten.
Es ist einzusehen, das ein Elektron, das sich auf einer kernferneren Schale befindet, eine absolut gesehen höhere Energie speichert als ein Elektron auf einer kernnäheren Schale (potentielle wie kinetische Energie).
Die Energiedifferenz ∆W von Schale zu Schale verringert sich mit zunehmendem Schalenradius, da die äußeren Schalen engen zusammen liegen als die inneren.)
Jede schale repräsentiert also durch seine Elektronen ein gewisses Energieniveau, welches mit zunehmendem Radius steigt.
Die Elektronen können sich nur auf diesen festgelegten Schalen/Energieniveaus aufhalten. Zwischen den Schalen ist ein Aufenthalt aus energetischen Gründen nicht möglich (Von Neben- und Spinquanten sei hier abgesehen).
Führen wir nur dem Atom und damit dann den Elektronen Energie zu, die der Energiedifferenz ∆W zweier, Schalen entspricht, so wird das Elektron befähigt, auf ein nächst höheres Energieniveau/Schale zu wechseln.
Die Verweilzeit auf einem höhere Energieniveau ist allerdings extrem kurz (etwa 10-8 sec).
Beim Rückfall des Elektrons auf sein ursprüngliches Energieniveau gibt es die Energiedifferenz in Form elektromagnetischer Strahlung, so genannten Strahlungsquanten wieder ab. <bb>
Das Springen der Elektronen zwischen den Schalen wird auch als Ouantensprung bezeichnet, die entstehenden Strahlungsquanten als Protonen. Sie sind kein Teilchen im klassischen Sinne. Ihr Energiegehalt entspricht der Energiedifferenz zweier Schalen, ihre Geschwindigkeit der der Lichtgeschwindigkeit C 0.
Eine Ruhemasse m des Protons und der damit verbundene Impuls lässt sich nach Einstein, W = m × C 02 , bestimmen. Eine Ruhemasse besitzt das Proton nicht.
Wir haben also gesehen, dass beim Quantensprung die erst zugeführte Energie in Form elektro-magnetischer Strahlungswellen wieder abgegeben wird.
Welche Frequenz besitzt diese Strahlung?
Um diese Frage zu beantworten, betrachten wir noch einmal die Elemente. Die Elemente unterscheiden sich durch ihrer Protonen und Neutronen bzw. auch Elektronen voneinander.
Die Schalen, also die Aufenthaltsorte der Elektronen repräsentieren einen energetischen Gleichgewichtszustand. Da dieses Energiegleichgewicht bei höherer Kernladungszahl, also mehr Protonen, also schwereren Elementen woanders liegt, als bei leichteren Elementen mit geringerer Kernladungszahl, ist einzusehen.
Daraus folgt, dass z.B. die 2. Schale - Energieniveau des Lithiums - einen anderen Radius zum Kern hat, also die 2. Schale des Sauerstoffs. Daraus folgt weiterhin, dass die Energiedifferenz zwischen 1. und 2. Schale des jeweiligen Elementes unterschiedlich ist.
Das Experiment ergibt nun, dass z.B. das Proton des Lithiums eine andere Frequenz abstrahlt, als das Proton von Sauerstoff, woraus wir jetzt folgende Erkenntnisse ziehen:
- Die Frequenz der elektromagnetischen Strahlung/Photon hängt vom Element bzw. dessen Schalenaufbau und der Anzahl der Elektronen ab.
- Für jede Frequenz ist eine bestimmte mindest Energiemenge aufzubringen, man spricht auch von Energiequantum W
- Je nach Energiezufuhr kann ein Element auch mehrere Frequenzen abstrahlen
- Der Zusammenhang von Energie und Frequenz wird durch einen Proportionalitätsfaktor, der Planck'schen Wirkungskonstante h hergestellt. H = 6,626179 × 10-34 JS
- W = h × f
- f = w / H
- W = Energie eines Strahlungsquantum
- f = Frequenz
- h = Plancksche Wirkungskonstante
elektromagnetisches Wellenspektrum
| Wellenlänge | Wellenart |
|---|---|
| 106 m = 1000km | Telegrafiewellen |
| 105 m = 100km | Telegrafiewellen |
| 104 m = 10km | Rundfunkwellen (Lang) |
| 103 m = 1km | Rundfunkwellen (Mittel) |
| 100 m | Rundfunkwellen (Kurz) |
| 10 m | Rundfunkwellen (Ultrakurz/Fernsehen) |
| 1 m | Mikrowellen (Ultrakurz/Fernsehen) |
| 10-1 m = 100 mm | Mikrowellen (Radar) |
| 10-2 m = 10 mm | Mikrowellen |
| 10-3 m = 1 mm | Infrarotwellen |
| 10-4 m = 0,1 mm = 100 μm | Infrarotwellen |
| 10-5 m = 0,01 mm = 10 μm | Infrarotwellen |
| 10-6 m = 1 μm | sichtbares Licht (770 nm) |
| 10-7 m = 100 nm | Ultraviolet (390 nm) |
| 10-8 m = 10 nm | Röntgenstrahlen (weich) |
| 10-9 m = 1 nm | Röntgenstrahlen (weich) |
| 10-10 m = 100 pm | Röntgenstrahlen (weich) |
| 10-11 m = 10 pm | Röntgenstrahlen (weich) |
| 10-12 m = 1 pm | γ - Strahlen (hart) |
| 10-13 m = 100 fm | γ - Strahlen (hart) |
| 10-14 m = 10 fm | kosmische Strahlen |
Das Spektrum der elektromagnetischen Welle zeigt uns, daß Licht nichts weiter als einen für uns sichtbaren Teil aus diesem Spektrum darstellt. Licht ist also einen elektromagnetische welle, wobei sich die Energie dieser welle als Phontonen, kleiner Energiequanten, fortpflanzt. Licht ist also die Aussendung einzelner Strahlungsbündel/Phontonen, deren Weg durch den Lichtstrahl begrenzt und gekennzeichnet wird. Die Ausbreitungsrichtung ist zumindest für den Bereich der geometrischen Optik als geradlinig anzusehen.
In der Aussendung von Phontonen liegt ein Dilemma, der Wellen-Teilchen-Dualismus. Während die Teilchenbetrachtung der Photonen von einer Korpus Kularstrahlung ausgeht, wollen wir an der Wellentheorie festhalten.
Beide Betrachtungen sind aber, bgesehen von der Qualität der Anschauung gleichwertig.
Wie bei jeder elektromagnetischen Welle stehen elektrischer und magnetischer Feldvektor rechtwinkelig aufeinander und beide rechtwinkelig zur Ausbreitungsrichtung, man spricht von Transversalwellen (ein wichtiger Umstand, da nur diese interferenzfähig sind.)
Licht braucht zur Fortpflanzung keinerlei Medium, seine Geschwindigkeit beträgt im leeren Raum Vakuum C.
- C = 3 × 108 m/s
Sie ist für alle Frequenzen, sprich das gesamte Spektrum gleich, wobei die Phasengeschwindigkeit gleich der Energiegeschwindigkeit gleich C ist.
- C = Vp = Ve
Aus der Geschwindigkeit ergibt sich der Zusammenhang
- C = λ × f
- λ = Wellenlänge
- f = Frequenz
Je dichter das Medium wird, um so geringer wird die Geschwindigkeit.(Lichtgeschwindigkeit, gemessen im Jahre 1673 von dem dänischen Astronom Olaf Römer, 1644 bis 1710). Die Frequenz der Lichtschwingung ist sehr hoch und beträgt im Mittel 10 15 Hz. Das menschliche Auge erfasst Wellenlängen im Bereich zwischen 390 nm (violett) und 770 nm (rot). Dieser sichtbare Bereich umfaßt im Gegensatz zum Hörbereich mit 10 Oktaven nur etwa 1 Oktave (1 Oktave -> Verdoppelung der Frequenz). Jede Wellenlänge kennzeichnet eine bestimmte Farbe im Lichtspektrum. Man nennt Licht einer bestimmten Wellenlänge monochromatisch.
An die Farbe rot (780 nm) grenzt der Infrarotbereich, eine unsichtbare Wärmestrahlung. An die Farbe violett (380 nm) grenzt die UV-Strahlung, die ja ihrer bräunenden Eigenschaften wegen sehr geschätzt wird. Die Mischung aller Farben im Farbspektrum ergibt den Farbeindruck weis (additive Farbmischung).
Wird der gesamte Frequenzbereich absorbiert, also kann keine sichtbare Frequenz emittiert (abgestrahlt) werden, entsteht der Farbeindruck schwarz (Subtraktive Farbmischung). Schwarz und Weiß sind also keine Farben sondern stellen nur Mischprodukte aus dem sichtbaren Spektrum dar . Genaugenommen gibt es nur 6 Farben im Spektrum, die sogenannten Spektralfarben:
Sie sind nicht weiter zerlegbar, der Übergang von Farbe zu Farbe ist allmählich und enthält viele Farbnuancen, so daß jede Spektralfarbe im Spektrum einen bestimmten Frequenzbereich einnimmt.
An dieser stelle ist es wichtig, den Zusammenhang von Farbe/Frequenz - zugeführter Energie - und Elementen herzustellen
Die Tatsache, das ein Element bei Energiezufuhr nicht nur eine bestimmte Frequenz ausstrahlt (emittiert) sondern genau diese Frequenz auch absorbiert, also in sich aufnimmt, öffnet den Bereich der Spektralanalyse.
Um diese sicherlich recht grobe Darstellung der Lichtentstehung abzuschließen, bleibt noch zu fragen, woher kommt eigentlich die Energie und um was für eine Energie handelt es sich, die notwendig ist, um Licht zu erzeugen.
Nun die Antwort darauf ist einfach. Jegliche Energieform ist geeignet.
Sonnenlicht
Die größte Energiequelle ist wohl die Sonne. Die ständigen Kernfusion, Kernspaltung und die sich daraus entwickelnde Wärme regt eine Vielzahl Elemente in der Sonne zum Strahlen an. So stahlt die Sonne praktisch über das gesamte Frequenzspektrum Energie aus. Vom Relativ schmalbandigen Lichtspektrum bekommen wir das Mischprodukt aus den Spektralfarben, das weiße Licht.
Im Prinzip strahlt jeder Körper, dessen Temperatur von 0 Kelvin unterschiedlich ist. Nach dem Wien'schen Verschiebungsgesetz rückt die Strahlung mit zunehmender Wärme/Energie in den Bereich des sichtbaren Frequenzspektrum und darüber hinaus.
Beispiel: Glühender Stahl, brennendes Streichholz usw.
Luminenz
Lichtstrahlung eines Körpers, unabhängig von seiner Temperatur, bezeichnet man•als Luminenz. Hierkann die Energiezufuhr in Form von ...
| Elektrischer Anregung | Elektroluminenz |
| Chemische Anregung (Fäulnis) | Chemoluminenz |
| Elektromagnetische und Teilchen Anregung (Radioaktivität) | Fluoreszenz |
| temperaturabhängiges Nachleuchten | Phosphorreszenz |
-- Jonathan Michael Scott 13:01, 31. Dez 2005 (CET)
Links
Verwandte Links: Klassische Physik · Relativitätstheorie · Quantenphysik · Elektromagnetische Wellen · Warpphysik
Übergeordnete Links: Politische Datenbank · Taktische Datenbank · Technische Datenbank · Medizinische Datenbank · Naturwissenschaftliche Datenbank · Astronomische Datenbank · Schiffsklassenregister · Schiffsregister · Speziesdatenbank